细胞死亡作为一种重要的生理过程,一直都是生命科学研究的热点。AbMole向您介绍几种重要的细胞死亡形式(细胞铁死亡、泛凋亡、铜死亡、双硫死亡、细胞套亡、兴奋性毒性、细胞焦亡和凋亡),及相应的热门抑制剂/诱导剂。
类型 | 形态特征 | 关键分子 |
铁死亡 | 线粒体膜密度增高、线粒体变小、线粒体嵴缩小或消失、外膜破裂 | Fe2+、LOXs、HSPB1、Nrf2 GPX4、NOX、 P53、Ferrostatin-1 |
泛凋亡 | 细胞质肿胀、膜破裂、染色质固缩、DNA 片段化、凋亡小体形成 | Caspase-1、Caspase-3、Caspase-7、Caspase-8、AIM2/Pyrin/NLRP3、PARP、Bax/Bcl、RIPK1、RIPK3、ZBP1 |
铜死亡 | 线粒体的收缩、细胞膜的破裂、内质网损伤以及 染色质破裂 | FDX1、DLAT、 DLST、HSP70、LIAS、Fe-S Cluster、ATP7A/B、SLC31A1 |
双硫死亡 | 细胞体积缩小、核皱缩、细胞膜表面形成泡状结构、 肌动蛋白丝聚集 | SLC7A11、GLUT1、GLUT3、LDHA、NADPH |
细胞套亡 | Cell-in-cell结构 | RhoA、ROCKI/II、E-cadherin、α-catenin、actomyosin、LC3、ATGs |
兴奋性毒性 | 神经元皱缩,神经核有染色质团块,内质网和线粒体扩张,嵴受损 | Ca2+、Glu、Na+、Cl-、ROS、Calpain、NMDAR |
细胞焦亡 | 细胞肿胀、焦亡小体形成、细胞膜破裂,胞质外流 | Caspase-1、Inflammasome、 Gasdermins、 IL-1β和 IL-18 |
细胞凋亡 | 凋亡小体形成、细胞萎缩、染色质固缩、核破碎、DNA 断裂 | 外源性途径:Fas、FASL、FASR、TNF-α、TNFR1/2、FADD、Caspase-8/10和Caspase-3/6/7 |
内源性途径:Bcl2、Apaf-1、Cyt C、 Caspase-9和Caspase-3/6/7 | ||
Caspase非依赖性细胞凋亡信号途径:BNIP3、AIF、EndoG、ARPP |
铁死亡(Ferroptosis)
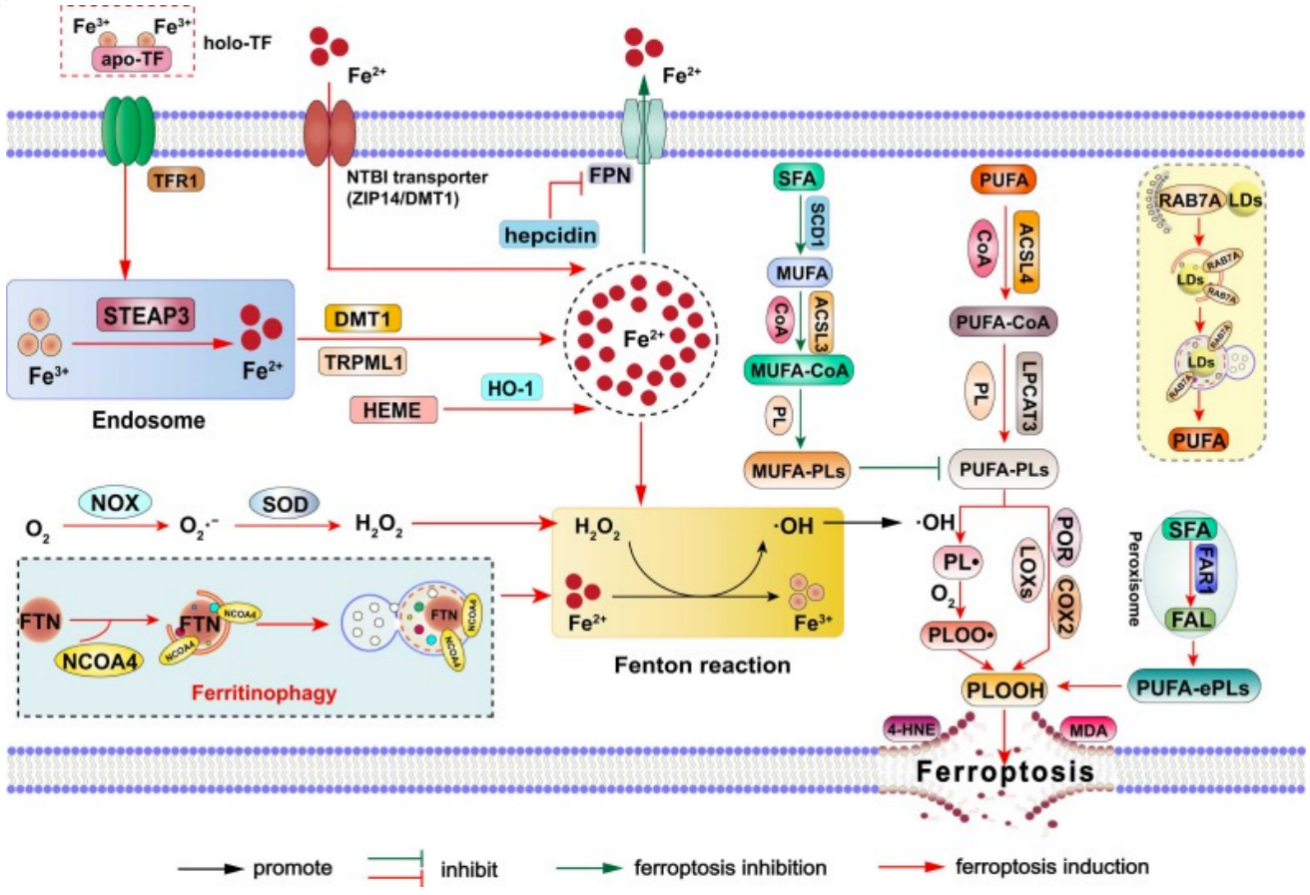
铁死亡是一种非凋亡程序性细胞死亡形式,主要由铁超载和脂质过氧化导致的过度氧化损伤以及抗氧化防御系统(包括系统XC(Systerm XC)/谷胱甘肽(GSH)/谷胱甘肽过氧化物酶 4(GPX4)途径和 GPX4 非依赖途径)受损引发,其特点为铁依赖性脂质活性氧(ROS)积累和膜多不饱和脂肪酸磷脂(PUFA-PLs)过氧化。
铁死亡相关产品推荐
目录号 | 产品名称 |
M13544 | Ammonium iron(III) citrate |
M5473 | Butylhydroxyanisole |
M2223 | Cisplatin |
M4879 | Cycloheximide |
M5558 | Deferoxamine mesylate |
M2679 | Erastin |
M21708 | Erastin2 |
M2698 | Ferrostatin-1 |
M6731 | FIN56 |
M11314 | iFSP1 |
M3865 | L-Buthionine-sulfoximine |
M45392 | MMRi62 |
M43932 | N6F11 |
M29297 | PKUMDL-LC-101-D04 |
M9060 | RSL3 |
M2076 | SP600125 |
M11044 | SRS16-86 |
M2197 | Sulfasalazine |
M18992 | Trigonelline |
M10626 | UAMC-3203 |
泛凋亡(PANoptosome)
泛凋亡是一种炎症性程序性细胞死亡(PCD)途径,由特定的诱因激活并受泛凋亡小体的调控,具有细胞焦亡(P)、细胞凋亡(A)和/或细胞坏死(N)的主要特征。一旦泛凋亡被激活,仅阻断这些细胞死亡途径中的任何一种形式都不能有效阻止泛凋亡的进展。
泛凋亡的特点是与细胞焦亡、细胞凋亡和/或坏死相关的信号转导因子参与其中,然后形成一种称为泛凋亡小体(PANoptosome)的多聚体复合物,从而在细胞稳态改变或其他不利条件下调节泛凋亡。尽管不同研究中 PANoptosome 的组成并不完全相同,但经典的 PANoptosome 主要由三种蛋白质组成: (1)传感器蛋白,如Z-DNA结合蛋白1(ZBP1)和NLR家族Pyrin域蛋白3(NLRP3);(2)具有caspase招募结构域的适配蛋白,如细胞凋亡相关斑点样蛋白(ASC);(3)具有催化作用的RIPK1、RIPK3和caspase-1/8。迄今为止,已发现两种经典的 PANoptosome 复合物,包括 ZBP1-PANoptosome和AIM2-PANoptosome。此外,RIPK1-PANoptosome和 NLRP12-PANoptosome也有相关报道。

泛凋亡相关产品推荐
目录号 | 产品名称 |
M2040 | BAY 11-7082 |
M3532 | Belnacasan |
M6164 | MCC950 |
M9263 | CY-09 |
M9729 | diABZI |
M5580 | Dimethyl fumarate |
M3390 | Disulfiram |
M5612 | Emricasan |
M9074 | GSK872 |
M9062 | Necrosulfonamide |
M19927 | Tetracycline |
铜死亡(Cuproptosis)
铜依赖性细胞死亡(又称为铜死亡)是一种新型的非凋亡性细胞死亡形式。目前已知的哺乳动物脂酰化蛋白质极少,而这些蛋白质集中在 TCA 循环中,TCA 循环活跃的细胞表现出蛋白质脂酰化增加,脂酰分子作为铜结合剂,能进一步促进蛋白质脂酰化聚集,Fe-S 簇蛋白质水平降低,以及热休克蛋白(HSP)70 增加,最终导致铜死亡的发生。

铜死亡相关产品推荐
目录号 | 产品名称 |
M3390 | Disulfiram |
M2083 | Elesclomol |
M5682 | Glutathione |
M11307 | 8-Hydroxyquinoline |
M2891 | NSC 319726 |
M3137 | Zinc Pyrithione |
双硫死亡(Disulfidptosis)
双硫死亡是一种由细胞内胱氨酸累积引起的细胞死亡形式。SLC7A11是溶质转运第7家族的第11个成员,同时也是胱氨酸/谷氨酸逆向转运蛋白,负责胱氨酸的摄取,而胱氨酸等二硫化物的积累会诱发二硫化物应激,对细胞产生毒性。正常情况下,NADPH 提供还原能力以抵消二硫化物应激,维持细胞平衡。然而,在葡萄糖饥饿状态下,通过磷酸戊糖途径(PPP)从葡萄糖产生的 NADPH 是有限的。SLC7A11 介导的胱氨酸摄取会进一步消耗细胞内的 NADPH,导致其耗竭和二硫化物分子积累,从而引发肌动蛋白细胞骨架蛋白之间二硫键的形成和肌动蛋白丝(F-actin)网络的崩溃,最终导致双硫死亡。

双硫死亡相关产品推荐
目录号 | 产品名称 |
M8659 | BAY-876 |
M6179 | Diethylmaleate |
M2679 | Erastin |
M25560 | HG106 |
M28266 | KL-11743 |
M5385 | N-Acetyl-L-cysteine |
细胞套亡(Entosis)
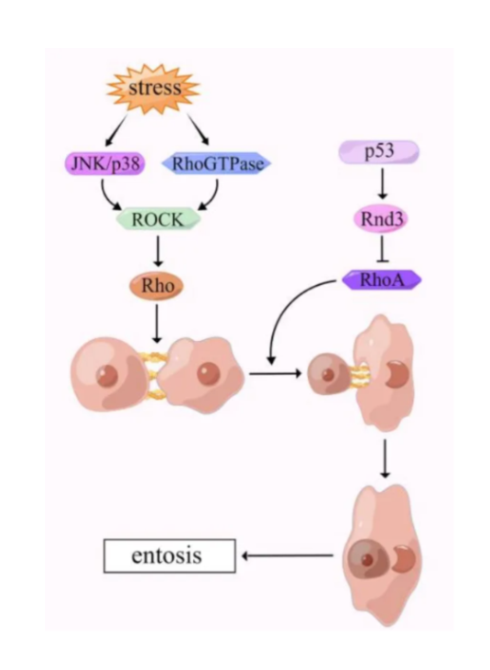
细胞套亡是一种非凋亡性的细胞死亡形式,其主要特征为一个活细胞主动内化并降解另一个活细胞。同时细胞套亡途径可由多种刺激诱发(如营养饥饿和紫外线辐射)。营养饥饿(尤其是葡萄糖饥饿)能通过激活内部细胞中的AMPK诱导细胞套亡,而紫外线辐射则可通过激活 JNK 和 p38 信号导致细胞套亡。
当细胞与细胞外基质(ECM)分离,导致一个细胞被另一个细胞内化时,就会引发套亡过程。细胞套亡需要激活多种分子信号通路,关键途径之一即为 Rho/ROCK/Actomyosin途径,该途径能调节肌动蛋白和肌球蛋白 II 的活性,对细胞吞噬至关重要。在细胞套亡过程中,入侵(被吞噬)的套亡细胞会形成一个富含肌动蛋白的结构,突出到吞噬细胞的细胞质中。肌球蛋白 II 被吸引到这一结构上并使其收缩,将入侵细胞拉入吞噬细胞。随后,被吞噬的细胞被吞噬它的细胞内的溶酶体降解。但值得注意的是,并非所有入侵细胞都会在经历套亡过程后死于溶酶体。入侵细胞可能会在宿主细胞内存活分裂,甚至逃脱宿主细胞。在正常发育过程中,细胞套亡在清除多余细胞以及塑造组织和器官方面发挥作用。在癌症中,细胞套亡可以通过促进邻近细胞的吞噬,有助于肿瘤的生长和侵袭。
细胞套亡相关产品推荐
目录号 | 产品名称 |
M9636 | Blebbistain |
M2019 | Go 6983 |
M1977 | U0126-EtOH |
M1817 | Y-27632 |
兴奋性毒性(Excitotoxicity)
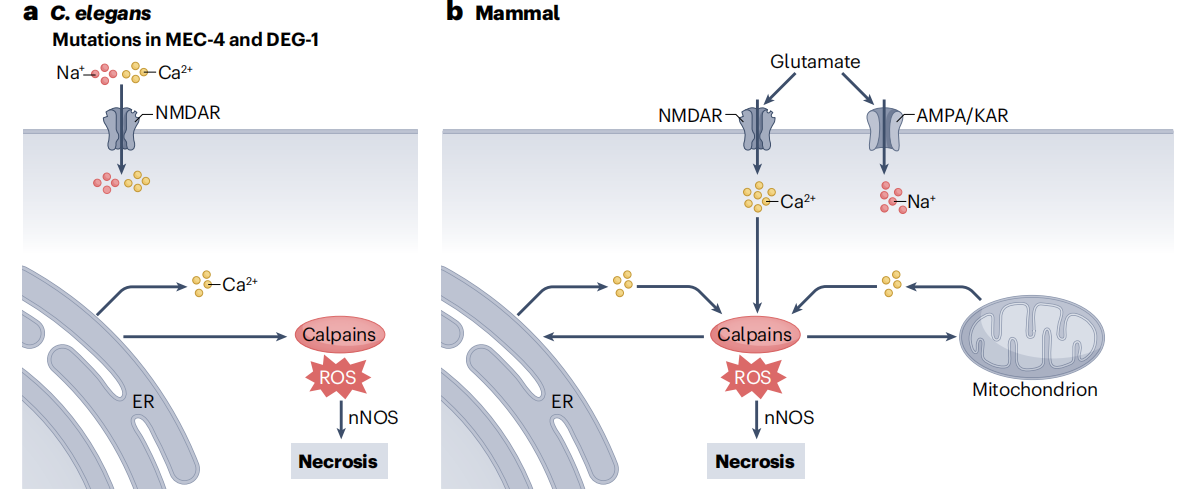
特定离子通道在过度激活后,细胞内离子平衡的破坏可导致一种称为兴奋性毒性的坏死。兴奋性毒性的特点是高浓度谷氨酸或其他兴奋性氨基酸在细胞外蓄积,从而导致谷氨酸受体受到过度刺激。它是缺血、脑外伤和癫痫发作等神经系统疾病的一种病理过程,同时还与亨廷顿氏症、多发性硬化症和肌萎缩侧索硬化症(ALS)等多种神经退行性疾病有关。谷氨酸兴奋性毒性的经典定义是,细胞外Ca2+通过N-甲基-d-天冬氨酸受体(NMDAR)大量流入,随后细胞内储存的 Ca2+释放,进一步增加胞浆游离 Ca2+浓度。其他谷氨酸受体(GRs)家族的过度刺激也会引发 Na+ 和 Cl- 离子的流入,同时该过程伴随着水的扩散以平衡渗透压,从而导致细胞肿胀。
兴奋性毒性相关产品推荐
目录号 | 产品名称 |
M7869 | Kainic acid |
M10269 | β-Spaglumic acid |
M39029 | Withanone |
细胞焦亡(Pyroptosis)
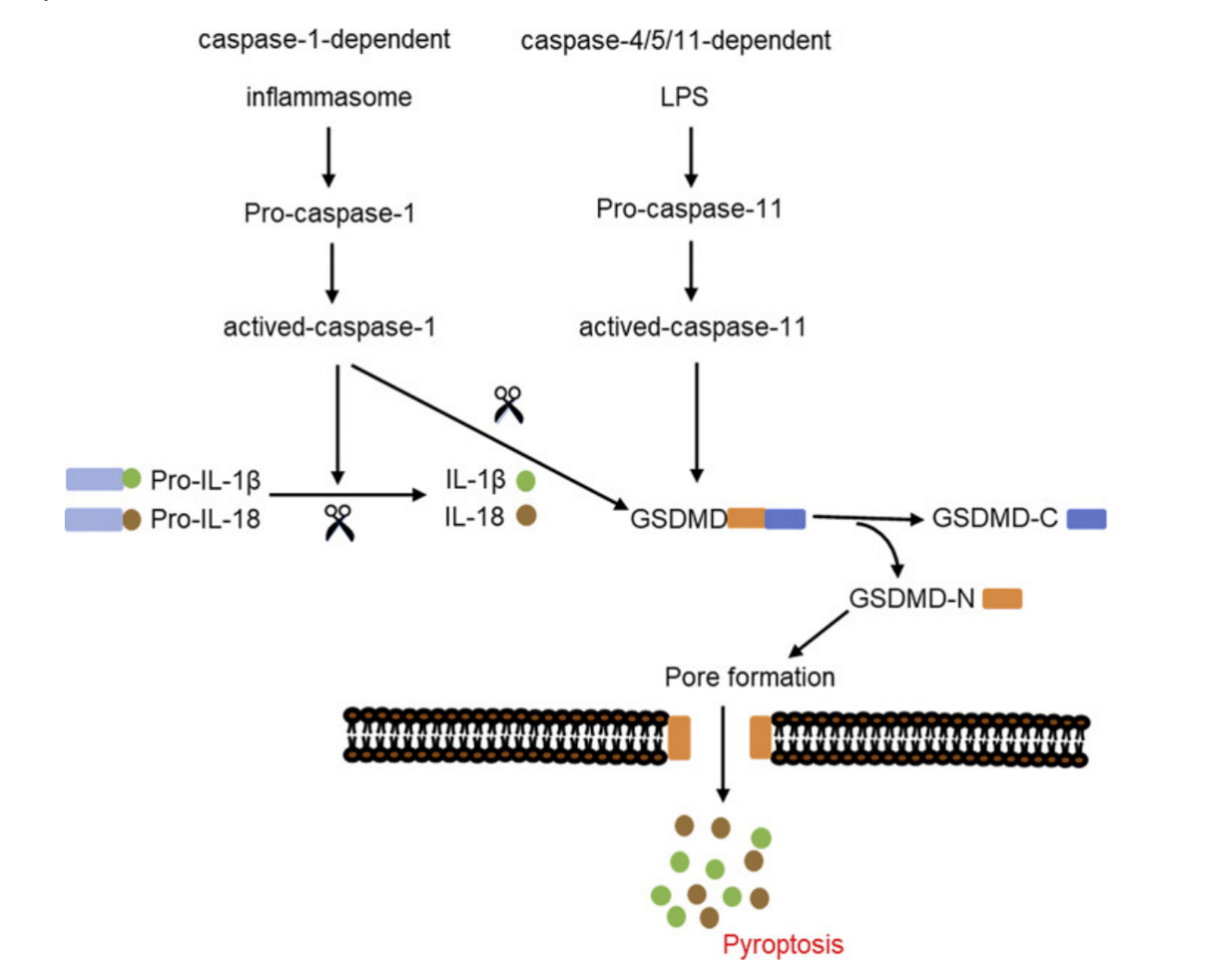
细胞焦亡是近年来的一个热点,同时也被定义为炎症细胞死亡程序。与细胞凋亡相比,细胞焦亡发生更快,并且伴随着细胞膜完整性的破坏和促炎因子的释放。该种死亡方式的特点是细胞肿胀破裂,核收缩,细胞内容物分泌,DNA 染色阳性,以及明显的促炎反应。
细胞焦亡分为经典途径(依赖于caspase-1)和非经典途径(依赖于 caspase-4、5、11)。在经典途径中,激活的炎症小体触发 caspase-1,裂解 GSDMD,并诱导下游炎症反应。在非经典途径中,脂多糖(LPS)通过激活鼠类caspase-11 及其人类同源物 caspase-4/5 诱导细胞焦亡。
细胞焦亡相关产品推荐
目录号 | 产品名称 |
M8340 | Ac-YVAD-cmk |
M2040 | BAY 11-7082 |
M3390 | Disulfiram |
M9189 | Eldecalcitol |
M45373 | NLRP3/AIM2-IN-2 |
M45372 | NLRP3/AIM2-IN-3 |
M4363 | Polyphyllin-VI |
M3970 | Scutellarin |
M3086 | Triclabendazole |
细胞凋亡(Apoptosis)
细胞凋亡是研究的最深入的细胞死亡方式之一,同时也是一个受到高度调节和控制的过程。在正常发育、自稳态维持、免疫耐受形成以及肿瘤监控中都具有重要的作用。介导细胞凋亡的主要信号通路有三种,分别为外源性细胞凋亡信号途径,内源性细胞凋亡信号途径以及Caspase非依赖性细胞凋亡信号途径。
在依赖于caspases的外源途径中,死亡受体如Fas在配体FasL的刺激下,通过接头蛋白FADD将caspase-8酶原招募到细胞膜上,形成死亡诱导信号复合物DISC。caspase-8酶原在这个复合物中活化,进而激活下游的caspases级联反应;在依赖于caspases的内源途径中,线粒体接收到凋亡信号后,向细胞质内释放Cyt c。Cyt c与Apaf-1和caspase-9前体形成凋亡复合体apoptosome,并活化caspase-9。caspase-9活化后激活下游的caspases级联反应外源途径中的caspase-8以及细胞毒性T淋巴细胞和自然杀伤细胞分泌的颗粒酶B,也可以切割并活化BcI-2家族的促凋亡因子Bid,激活内源凋亡途径。在caspases非依赖性细胞凋亡途径中,线粒体释放凋亡因子EndoG,AIF等,直接进入细胞核,引发DNA断裂。另一方面颗粒酶A能促使位于内质网的SET复合物从内质网上解离下来,转移到细胞核内并活化,切割核DNA。

细胞凋亡相关产品推荐
目录号 | 产品名称 |
M38828 | Alphitolic acid |
M44809 | Cinchonine hydrochloride |
M40996 | CWI1-2 |
M9075 | (R)-(+)-Etomoxir sodium salt |
M13379 | Guggulsterone |
M3291 | Hydroxyurea |
M2226 | Melatonin |
M38823 | Phytosphingosine |
M6209 | Rotenone |
M7246 | Sanguinarine chloride |
M10566 | Valepotriate |

更多产品详情,敬请关注:www.abmole.cn
鸣谢:
1. Liu H, Yao Q, Wang X, et al. Biomed Pharmacother. 2024 Jan;170:116072.
2. Zhou Z, Li Q. Kidney Dis (Basel). 2023 Jun 24;9(6):443-458.
3. Xu X, Xu XD, Ma MQ, et al. Biomed Pharmacother. 2024 Jan 2;171:116112.
4. Li X, Chen X, Gao X. Front Aging Neurosci. 2023 Dec 19;15:1300405.
5. Li SR, Bu LL, Cai L. Signal Transduct Target Ther. 2022 May 13;7(1):158.
6. Hajibabaie F, Abedpoor N, Mohamadynejad P. Biology (Basel). 2023 Nov 13;12(11):1426.
7. Park W, Wei S, Kim BS, et al. Exp Mol Med. 2023 Aug;55(8):1573-1594.
8. Wu Y, Wen X, Xia Y, Yu X, Lou Y. Front Oncol. 2023 May 29;13:1170336.
9. Ojasalu K, Lieber S, Sokol AM, et al. Theranostics. 2023 Mar 21;13(6): 1921-1948.
10. Neves D, Salazar IL, Almeida RD, Silva RM. Life Sci. 2023 Sep 1;328:121814.
11. Yuan J, Ofengeim D. Nat Rev Mol Cell Biol. 2023 Dec 18.
12. Liu X, Nie L, Zhang Y, et al. Nat Cell Biol. 2023 Mar;25(3):404-414.
13. Zheng P, Zhou C, Ding Y, Duan S. J Exp Clin Cancer Res. 2023 Apr 27;42(1):103.
14. Zhong Z, Zhang C, Ni S, et al. Redox Biol. 2023 Jul;63:102711.
15. Wang L, Zhu Y, Zhang L, et al. Cell Death Dis. 2023 Dec 21;14(12):851.
16. Cai H, Lv M, Wang T. Cancer Med. 2023 Dec;12(24):22206-22223.