关于FGF-4
成纤维细胞生长因子(Fibroblast Growth Factors,FGFs)是一类普遍存在于哺乳动物体内的促细胞分裂肝素结合蛋白,其与受体FGFR均在种间高度保守。FGFs可诱导调节细胞增殖分化、胚胎发育、血管再生、损伤修复、肿瘤发生等多个生理进程[1]。近岸类器官课堂:类器官培养关键细胞因子之FGF家族
FGF-4隶属FGF旁分泌亚家族,最初从人胃肿瘤中分离,正常情况下在成人体内少量表达于十二指肠、回肠和结肠中以维持肠干细胞稳态[2]。FGF-4通过硫酸乙酰肝素依赖性路径传递信号,可激活配体FGFR(与FGFR4结合特异性最强)启动损伤修复、器官再生和代谢调控[3]。在人胚胎发育过程中,FGF-4助力干细胞的自我更新与胚胎磨牙芽的发育。
FGF-4与类器官培养
1 肠道类器官
2014年,研究人员使用iPSC来源的类器官首度在体外构建了3D人体肠道组织模型。实验发现,生长因子FGF-4和WNT-3a可促进CDX2+后肠内胚层特异性模式化,并产生三维球状体[4]。2015年的一篇论文则提出,FGF-4在肠道类器官培养中的主要作用可能是抑制hPSC向肝谱系的分化[5]。在2017年和2018年相继发表的两项研究指出,类器官在短期暴露于FGF-4和CHIR 99021(一种Wnt/β-catenin信号通路激活剂)的培养条件下,更倾向于形成十二指肠类器官;而长期暴露则引导其向回肠组织的基因表达模式发展。值得注意的是,当完全缺乏CHIR 99021和FGF-4的添加时,体外实验中未能观察到后肠球状体的形成[6,7]。
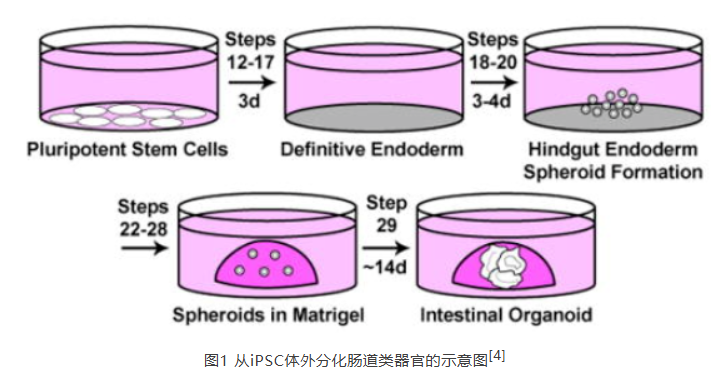
2 胃类器官
2021年发表于Nature Protocol的文章介绍了使用hPSC产生功能性胃细胞的方法。该实验方法使用Activin A将hPSC分化成定形内胚层(DE),然后添加FGF 4与CHIR 99021产生自由漂浮的3D前肠后部球状体,并最终形成胃窦和胃底类器官[7]。
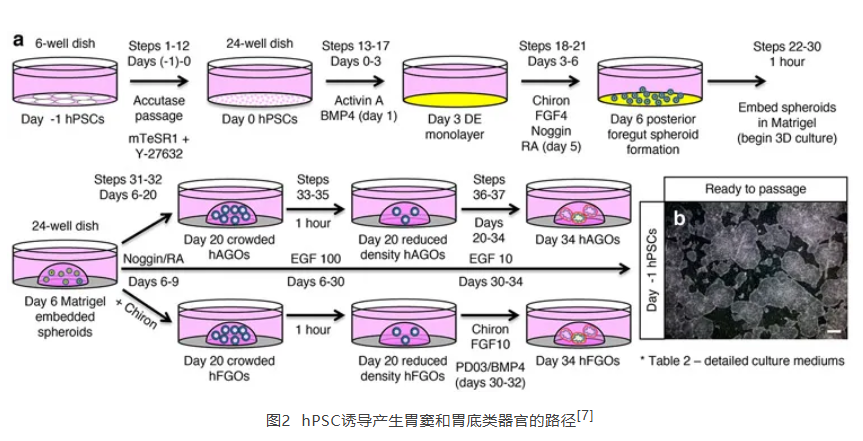
3 肺类器官
为了应对SARS-CoV-2等呼吸道疾病,体外肺部3D模型一直是研究的重点。来自美国密歇根大学医学院的研究团队通过添加Noggin、SB、FGF-4、CHIR99021,从hPSC开发出人肺类器官(HLO)[8]。该研究得到的HLO由肺的上皮和间充质隔室组成,具有上气道样上皮以及被平滑肌和肌成纤维细胞包围的基底细胞。与此同时,HLO还拥有未成熟纤毛细胞和肺泡样结构域。
2021年,发表于Nature的一篇文章使用FGF-4+CHIR 99021从hPSC获得肺类器官,并检测到类器官中肺泡II型细胞标志物的表达[9]。使用SARS-CoV-2感染肺类器官,观测到趋化因子被高度诱导,与COVID-19患者感染症状类似。基于肺类器官模型,研究者对FDA批准的药物进行了高通量筛选,发现SARS-CoV-2感染抑制剂伊马替尼、麦考酚酸(MPA)和盐酸奎纳克林(QNHC)等,为COVID-19治疗提供了新思路。
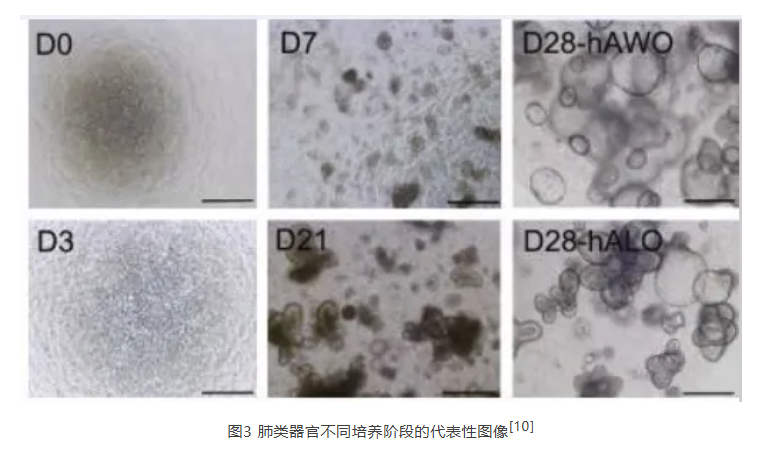
4 肝脏类器官
脂肪型肝炎由多种因素导致,其中非酒精性脂肪肝(NAFLD)以及非酒精性脂肪性肝炎(NASH)的全球患病率及病死率非常高。为了深入探究脂肪性肝炎基因型-表型关联及其与糖类代谢之间的联系,2022年,发表于Cell上的一篇研究通过添加FGF-4和CHIR 99021,构建了单纯性脂肪变性和脂肪性肝炎的类器官模型[11]。实验发现葡萄糖激酶调节蛋白(GCKR)-rs1260326-T等位基因仅在同时患有糖尿病的前提下加重NASH,为糖尿病-NAFLD/NASH的治疗奠定了分子基础。
5 心脏类器官
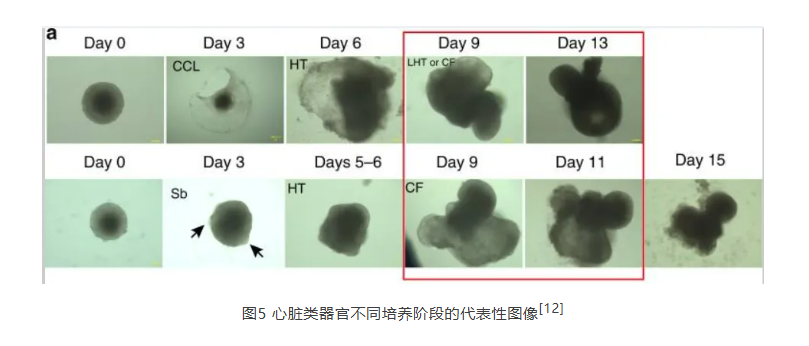
FGF及其受体FGR1在心脏发育中发挥至关重要的作用,如FGF-4-FGFR1通路调节心肌细胞与其他细胞之间的增殖平衡以确保心室结构正确。为了探究心脏发育机制,2020年的一篇研究探索了体外心脏类器官模型建立的路径[12]。向来自小鼠胚胎干细胞的胚状体添加外源FGF-4后,成功诱导初始心肌细胞的增殖和第八天心室的形成。与家族内的其他因子比较,FGF-4的诱导效率最高(两次实验中,FGF-4为88%和78%,FGF10为42%和25%)。最终成功获得具有心肌细胞超微结构特性的心脏类器官,并表达相关转录因子与结构基因,为体外心脏药物筛选、诊疗等提供了新的平台。
近岸蛋白提供高活性,高批间一致性的重组FGF-4蛋白,并经过类器官培养验证,让您的类器官培养更可控!
产品数据
高活性
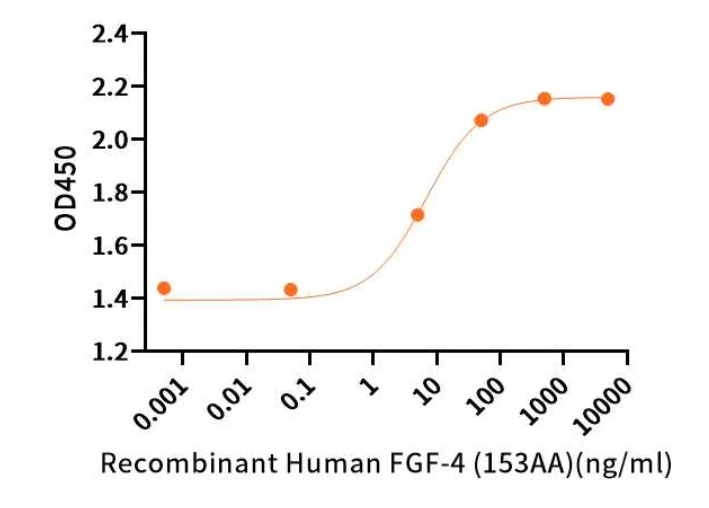
Measured in a cell proliferation assay using MCF7 Human breast cancer cells.The ED50 for this effect is 2-20 ng/ml.
高批间一致性
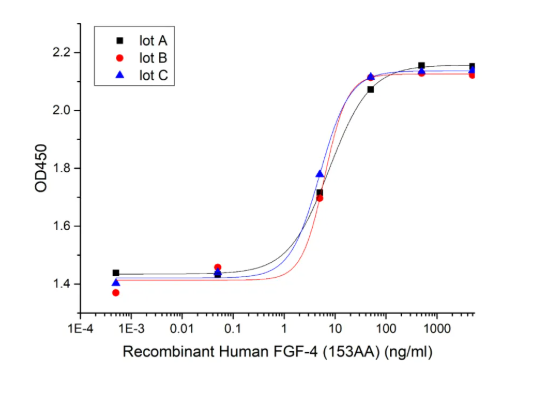
Three independent lots were tested for activity and plotted on the same graph to show lot-to-lot consistency of FGF-4(Cat#CR08).
类器官培养验证
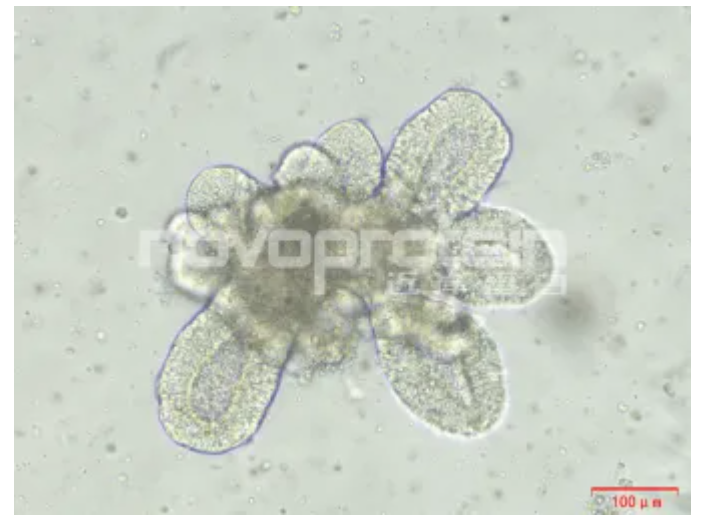
Human intestinal organoids (ipsc source) were cultured with Activin A(Cat#C687) , BMP-4(Cat#CR93) , EGF (Cat#C029) , Wnt3a (Cat#C22R), Noggin (Cat#C028), R-spondin 1 (Cat#CX83) and FGF-4 (Cat#CR08) . The organoids showed good morphology.
相关产品:
类器官培养类型 | 相关因子 |
胃类器官 | Activin A、BMP-4、EGF、FGF-4、FGF-10、Noggin、R-spondin 1、Wnt3a |
肠类器官 | Activin A、BMP-4、EGF、FGF-4、Noggin、R-spondin 1、Wnt3a |
肝类器官 | Activin A、BMP-4、BMP-7、FGF-7、FGF-10、FGF-19、HGF、OSM、R-Spondin 1 |
肺类器官 | Activin A、FGF-4、FGF-7、FGF-10、Noggin、SHH、Wnt3a |
前列腺类器官 | EGF、FGF-10、Noggin、R-spondin 1、Wnt-3a |
脑类器官 | |
内耳类器官 | BMP-4、FGF basic |
视网膜类器官 | SHH、Wnt-3a |
乳腺类器官 | EGF、FGF basic、FGF-7、FGF-10、Heregulinβ-1、Noggin、R-Spondin 1、R-Spondin 3、Wnt-3a |
肾脏类器官 | BMP-2、BMP-4、BMP-7、FGF basic、FGF-9、Activin A、FGF-7、GDNF、R-Spondin 1 |
心脏类器官 | Activin A、BMP-4、FGF basic、TGF-beta 1、Transferrin |
血管类器官 | BMP-4、FGF basic、VEGF |
参考文献
[1]Xie, Yangli et al. “FGF/FGFR signaling in health and disease.” Signal transduction and targeted therapy vol. 5,1 181. 2 Sep. 2020, doi:10.1038/s41392-020-00222-7
[2]Tian, Haoyu et al. “Fibroblast Growth Factors for Nonalcoholic Fatty Liver Disease: Opportunities and Challenges.” International journal of molecular sciences vol. 24,5 4583. 26 Feb. 2023, doi:10.3390/ijms24054583
[3]Morita, Hideaki, and Masaaki Hoshiga. “Fibroblast Growth Factors in Cardiovascular Disease.” Journal of atherosclerosis and thrombosis vol. 31,11 (2024): 1496-1511. doi:10.5551/jat.RV22025
[4]McCracken, Kyle W et al. “Generating human intestinal tissue from pluripotent stem cells in vitro.”Nature protocolsvol. 6,12 1920-8. 10 Nov. 2011, doi:10.1038/nprot.2011.410
[5]Tamminen, Kaisa et al. “Intestinal Commitment and Maturation of Human Pluripotent Stem Cells Is Independent of Exogenous FGF-4 and R-spondin1.”PloS onevol. 10,7 e0134551. 31 Jul. 2015, doi:10.1371/journal.pone.0134551
[6]Tsai, Yu-Hwai et al. “In vitropatterning of pluripotent stem cell-derived intestine recapitulatesin vivohuman development.”Development (Cambridge, England)vol. 144,6 (2017): 1045-1055. doi:10.1242/dev.13845
[7]Zhang, Ran-Ran et al. “Human iPSC-Derived Posterior Gut Progenitors Are Expandable and Capable of Forming Gut and Liver Organoids.” Stem cell reports vol. 10,3 (2018): 780-793. doi:10.1016/j.stemcr.2018.01.006
[8]Dye, Briana R et al. “In vitro generation of human pluripotent stem cell derived lung organoids.” eLife vol. 4 e05098. 24 Mar. 2015, doi:10.7554/eLife.05098
[9]Han, Yuling et al. “Identification of SARS-CoV-2 inhibitors using lung and colonic organoids.”Naturevol. 589,7841 (2021): 270-275. doi:10.1038/s41586-020-2901-9
[10]Pei, Rongjuan et al. “Host metabolism dysregulation and cell tropism identification in human airway and alveolar organoids upon SARS-CoV-2 infection.”Protein & cellvol. 12,9 (2021): 717-733. doi:10.1007/s13238-020-00811-w
[11]Kimura, Masaki et al. “En masse organoid phenotyping informs metabolic-associated genetic susceptibility to NASH.”Cellvol. 185,22 (2022): 4216-4232.e16. doi:10.1016/j.cell.2022.09.031
[12]Lee, Jiyoung et al. “In vitro generation of functional murine heart organoids via FGF-4 and extracellular matrix.” Nature communications vol. 11,1 4283. 3 Sep. 2020, doi:10.1038/s41467-020-18031-5
北京拜尔迪是近岸蛋白的授权代理商,更多产品,敬请咨询!
