NK细胞抑制剂 
Anti Asialo GM1(Anti AsGM1)
糖脂神经节苷脂GM1(ASGM1)在感染病毒时的T细胞及自然杀伤(NK)细胞中表达。ASGM1局部存在于NK和CD8(+)细胞的脂筏结构中,抗Asialo- GM1抗体可降低在各种小鼠、大鼠中的NK细胞活性。
接种抗Asialo-GM1抗体至实验动物,去除NK细胞,用于NK细胞的功能分析或移植其他物种来源的肿瘤组织至小鼠体内1)2)。
ASGM1也在嗜碱性细胞中表达,有报告称,抗Asia-GM1抗体也可用于去除嗜碱性细胞3)。
■ 参考文献
1) | Kasai M., Iwamori M., Nagai Y., Okumura K., and Tada T. : J. Immunol., 10, 175 (1980). |
2) | Habu S., Fukui H., Shimamura M., Kasai M., Nagai Y., Okumura K., and Tamaoki N. : J. Immunol., 127, 34 (1981). |
3) | Hideto, N., Kaori, M., Yohei, K., Yoshiyuki, M., and Hajime K., .: J. Immunol., 186, 10, 5766(2011) |
◆原理介绍
Anti Asialo-GM1(Rabbit)抗血清可以减少大鼠或者小鼠来源的自然杀伤细胞(NK 细胞)的活性。该抗体可以与 NK 细胞发生特异性结合,从而抑制 NK 细胞非特异性杀伤靶细胞的活性。NK 细胞是一种免疫监视细胞,其靶细胞包括肿瘤细胞、同种异体移植的器官、组织等。可运用于药物筛选,器官移植,自身免疫疾病等研究。
每个产品有具体的体内外的滴定数据。
◆特点
● 已经体内NK细胞活性验证
● 众多文献应用案例
特性 | 抗Asialo-GM1抗体、冻干品 |
免疫方法 | 牛脑组织纯化的Asialo-GM1甲基化BSA(bovine serum albumin),与FCA(Freund’s complete adjuvant) 同时对兔免疫。 |
纯化方法 | 50%硫酸铵盐化后,使用含有磷酸缓冲液(pH=7.2)的生理盐水透析。 |
特异性 | 与小鼠、大鼠的NK细胞以及小鼠胚胎胸腺细胞反应。 |
复溶 | 请在1 mL蒸馏水中复溶。建议使用磷酸缓冲液(pH 7.2)进行稀释。 |
接种方法 | 一只小鼠静脉注射10~50 μL。 |
◆注射方法
小鼠-静脉注射:
10-50 μL(推荐 20 μL)具体剂量由滴度和规格而定。第一次注射在4天内有效,因此两周内需要注射3-4次。
大鼠-静脉注射:
50-250 μL(小鼠剂量的4或5倍)具体剂量还须考虑大鼠的健康状况、体重和 NK 活性。
小鼠和大鼠-腹腔给药:
同等剂量或多于静脉注射。
◆产品信息
制备:
| 从牛脑组织里提纯的 Asialo-GM1 与甲基化牛血清白蛋白和弗氏完全佐剂一起使用,可进行反复免疫。用含有磷酸缓冲盐水(ph7.2)的 50% 硫酸铵透析后,得到血清里的丙种球蛋白(Gammaglobulin)片段。 |
内容: | 含有唾液酸抗体 GM1 的兔血清 50% 硫酸铵盐析分层物(含蛋白量约 10 mg/mL)。 |
提纯法: | 50% 的硫酸铵盐析后 ,用含有磷酸缓冲液的生理盐水透析,然后冻干。 |
特异性: | 作用于小鼠和大鼠的自然杀伤细胞;小鼠单核细胞(是一种不含自然杀伤细胞、骨髓、胎儿肝细胞和裸鼠脾脏巨噬细胞的肝细胞);小鼠胎儿胸腺细胞(12日龄;生存率不断降低直到没有出现新生小鼠)(备注:如果浓度高,也能作用于成熟的T淋巴细胞) |
免疫球蛋白类型: | IgG、IgA 和 IgM |
重组: | 建议用蒸馏水(1 mL)。由于该产品是使用盐来进行冻干的,如果用其它溶剂如 PBS 或 MEM,就能增加其盐浓度。 |
抗体滴度: | 通过免疫凝聚实验得出结果,抗体滴度比例约 1 : 1,000 |
保存方法: | 存储在2~10℃下 |
包装规格: | 1mL样瓶 |
形状: | 干冻品
|
欲了解详情请看相关资料
◆应用案例
适用的动物模型 | 运用 |
肿瘤动物模型 | 与抗肿瘤药物混合后注入肿瘤动物模型内,研究抗肿瘤药物的作用机理。 |
肝纤维化动物模型 | 与治疗肝纤维化的药物混合后注入动物模型体内,研究抗肝纤维化药物的作用机理。 |
器官移植动物模型 | 器官移植后,会产生免疫排斥反应,机体内的免疫监视会清除”异己“的细胞和器官。 可用于研究器官移植后使用的免疫抑制剂的作用机理 |
自身免疫疾病动物模型 | 研究治疗自身免疫疾病药物的作用机理。 |
干细胞动物模型 | 抑制 NK 细胞的活性,从而有利于干细胞动物模型的建立。 |
糖尿病动物模型 | 研究炎症与糖尿病的关系。 |
◆抗Asialo-GM1抗体体外活性
向抗Asialo-GM1抗体中添加豚鼠来源补体,并在BALB/c小鼠的胰腺细胞中进行处理。通过靶向YAC-1细胞(●)体外检测NK活性。
效应子/靶标的比率为50:1,○表示补体处理后BALB/c小鼠胰腺细胞的NK活性。
※ BALB/c小鼠经聚(I:C)钠盐100 μg(0.2 mL的500 μg/ mL)处理后,正常饲养18小时后开始下一步操作。
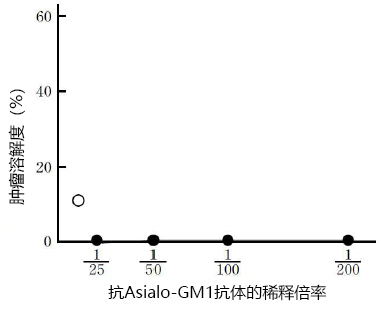
◆抗Asialo GM1抗体体内活性
向BALB/c小鼠腹腔内注射抗Asialo-GM1抗体,并检测单次给药(效应子/靶标= 50:1)3天后收集的胰腺细胞对YAC-1细胞的肿瘤溶解度。
※ BALB/c小鼠经聚(I:C)钠盐100 μg(0.2 mL的500 μg/ mL)处理后,正常饲养18小时后开始下一步操作。
■ 对照:正常兔血清
腹腔注射量 | 肿瘤溶解度(%) |
100 μL | 70.8 |
■ 抗Asialo-GM1抗体
腹腔注射量 | 肿瘤溶解度(%) |
10 μL | 7 |
25 μL | 8.4 |
50 μL | 2 |
100 μL | 0 |
※ 本页面产品仅供研究用,研究以外不可使用。
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| 014-09801(986-10001) | Anti asialo GM1 (Rabbit) NK细胞抑制剂 | 1 mL | for Immunochemistry |
拜尔迪是FUJIFILM wako授权代理商,
更多产品请咨询:
北京拜尔迪生物技术有限公司
咨询热线:010-62960866
点击![]() NK细胞抑制剂.pdf下载产品彩页,或向代理商拜尔迪索要纸质版本。
NK细胞抑制剂.pdf下载产品彩页,或向代理商拜尔迪索要纸质版本。
了解应用案例
Anti Asialo GM1的抗血清可以与NK细胞(自然杀伤细胞)结合,抑制NK细胞非特异性杀伤靶细胞的活性。靶细胞包括肿瘤细胞,同种异体移植的器官、组织等。可用于药物筛选、器官移植、自身免疫疾病研究等。NK细胞属于天然免疫细胞,具有免疫监视功能。
特异性:小鼠、大鼠的NK细胞,小鼠单核细胞(不含有NK细胞的肝脏细胞,骨髓,胎儿肝脏细胞,裸鼠巨噬细胞的脾细胞),胎儿T淋巴细胞(12天)。
◆研究糖尿病的免疫治疗
据报道,抗细胞凋亡细胞因子IL-15具有促进NK细胞和T细胞(包括调节性T细胞,Tregs)存活和激活上述两种细胞活性的功能。在患有糖尿病的NOD小鼠体内反复注射IL-15。如果每天一次,注射2周,既不抑制也不加速未处理NOD小鼠患糖尿病的情况。但是NK细胞活性丧失的NOD小鼠注射IL-15可以明显减少糖尿病的发病率和延迟糖尿病发病时间,但是NK细胞活性丧失不注射IL-15的小鼠依然病发糖尿病。在用IL-15处理,NK细胞活性丧失的NOD小鼠体内产生的保护效应与CD4+CD25+ Tregs免疫抑制活性增加有关。在该项实验中,用Anti AsGM1注射小鼠,抑制NK细胞活性,导致NOD小鼠NK细胞活性缺失。
参考文献:Jinxing Xia et al., Clinica l Immunology.(2010) 134, 130–139 <全文>
◆研究败血症中NK细胞的功能
NK细胞和NKT细胞都属于天然免疫系统,但在细菌引起的败血症中这两种细胞的作用是有争议。用Anti Asialo GM1处理小鼠,成为NK细胞活性抑制的小鼠;用CD1d单抗处理小鼠,成为NKT细胞活性抑制的小鼠;同时用同型对照单抗处理小鼠,作为阴性对照。之后这些小鼠感染肺炎链球菌。分析血清和组织样品中细菌的含量,细胞因子,脾细胞凋亡率、用流式鉴定细胞,同时也分析脾细胞miRNA的表达。结果发现NK细胞活性抑制的小鼠延长了存活率。一旦NKT细胞激活抑制,与其他细胞群相比,脾脏的NK (CD3−/NK1.1+)细胞数目增加。NKT细胞活性抑制导致小鼠体内的细菌含量升高,导致血清和脾细胞IFN-γ水平升高。抗CD1d处理小鼠的脾细胞miRNA分析显示miR-200C和miR-29a下调,miR-125a-5p上调。这些变化发生在NK细胞活性抑制后。NK细胞可能与肺炎球菌肺炎的死亡率有关。抑制NKT细胞的激活导致(CD3−/NK1.1+)细胞数目增加,IFN-γ水平升高,改变脾细胞miRNA表达。
参考文献:Eirini Christaki et al., Journal of Immunology Research, Volume 2015 (2015),Article
ID 532717, 10 pages <全文>
◆研究自身免疫性疾病的NK细胞功能
NK细胞是先天免疫淋巴细胞,在先天免疫和适应性免疫中均起着关键性作用。它在小鼠体内通过NK细胞消耗 Abs,特别是抗唾液酸GM1 (ASGM1),起关键作用。此次研究中,我们通过整个嗜碱性粒细胞群体组成如表达NK细胞群一样,来表达ASGM1以及CD49b(DX5),并通过抗ASGM1在体内通过嗜碱性粒细胞消耗的抗FcεRIαAb有效地消融。抗ASGM1介导的嗜碱性粒细胞的消耗与各种小鼠品系的NK细胞消耗有关,与NK1同种异型和MHC H2单体型(包括C57BL/6,BALB/c,C3H和小鼠A/J)无关。这些结果将嗜碱性粒细胞定义为以前未被认识到的抗ASGM1介导细胞消耗的靶标,并引起人们对嗜碱性粒细胞的关注,而不是NK细胞或除了NK细胞外对抗ASGM1处理的小鼠中观察到的某些表型。
参考文献:Nishikado H, Mukai K, Kawano Y, et al. NK cell-depletinganti-asialo GM1 antibody exhibits
a lethal off-target effect on basophils invivo[J]. The Journal of Immunology,
2011, 186(10): 5766-5771<全文>
◆研究肿瘤的免疫治疗
肿瘤的发展过程包括血管新生,肿瘤尺寸增大和肿瘤转移。使用CXCL14/BRAK (CXCL14) 转基因小鼠研究过度表达的CXC趋化因子配体14 (CXCL14) 在上述生物学现象中的作用。与野生型小鼠相比,转基因小鼠经AOM/DSS诱导的结肠血管新生的发病率显著低很多。肿瘤细胞注射到这些小鼠后,肿瘤尺寸发生变化。与野生型的相比,转基因小鼠肺中转移小瘤的数目明显少,肿瘤的尺寸也明显变小。在注射肿瘤前后注射Anti Asialo GM1减少了CXCL14在肿瘤生长方面和肿瘤转移的抑制效应,表明激活的NK细胞在CXCL14介导的抑制肿瘤生长和转移期间起重要作用。CXCL14也表达在B16黑色素瘤细胞内表明NK细胞在肿瘤转移方面的重要性。而且转基因小鼠在注射肿瘤细胞后的存活率显著增长。这些转基因小鼠没有明显的不正常,预计肿瘤抑制/预防方面CXCL14起着重要作用。
参考文献:Hata R et al.,Scientific Reports(2015) 5 : 9083 | DOI: 10.1038/srep09083 <全文>
动物模型 | 运用 |
肿瘤动物模型 | 与抗肿瘤药物混合后注入肿瘤动物模型体内,研究抗肿瘤药物是否通过激活NK细胞活性达到杀伤肿瘤细胞的作用。 |
肝病动物模型 | 与治疗肝病的药物混合后注入动物模型体内,研究药物是否通过激活NK细胞活性达到治疗肝病的效果。 |
器官移植动物模型 | 器官移植后会发生免疫排斥反应,机体内的免疫监视系统会清除:异己“的细胞和器官。可用于研究器官移植后免疫抑制剂的作用机理。 |
自身免疫疾病动物模型 | 研究治疗自身免疫疾病药物的作用机理。 |
干细胞动物模型 | 移植NK细胞活性,有利于干细胞动物模型的建立。 |
◆参考文献
◆其他文献
本公司的抗Asialo-GM1抗体在以下为代表的各种文献中均有应用案例。
1. | Hudson, W. A., Li, Q., Le, C., and Kersey, J. H., : Leukemia, 12, 2029 (1998). |
2. | Murphy W. J., Durum S. K., Longo D. L., : PNAS, 89, 10, 4481 (1992). |
3. | Bentzmann S., Roger P., Dupuit F., Bajolet-Laudinat O., Fuchey C., Plotkowski C. M., Puchelle E. : Infection and immunity, 64, 5, 1582 (1996). |
4. | Nishikado H., Mukai K., Kawano Y., Minegishi Y., Karasuyama H. : J. Immunol., 186, 10, 5766(2011). |
5. | Victorino, F., Sojka, K. D., Brodsky, S. K. McNamee, N. E., Masterson, C. J., Homann, D., Yokoyama, M. W., Eltzschig, K. H., Clambey, T. E., : J. Immunol., 195, 10, 4973(2015). |